肌萎縮性脊髓側索硬化症(漸凍人症,ALS)如死亡之吻,毫無預警向無戒備的受害者來襲。漸凍人症患者往往難逃死神魔爪,他們控制肌肉的能力日復日流逝,最終會連控制呼吸的能力都會失去,平均存活時間僅二至四年。人體的運動神經元負責控制肌肉運動,而在眾多影響運動神經元的神經退化性疾病中,漸凍人症最為常見,每10萬人中就有約4.4人患上此病。
死神不曾特別眷顧卓越的偉人,著名英國理論物理學家霍金(Stephen Hawking)亦無法逃離其魔掌,他的超人智慧就被困在受漸凍人症摧殘的身體中,晚年時只能透過使用單邊臉頰肌肉控制語音生成裝置與人溝通。
漸凍人症目前無藥可醫。科學家長期以來努力揭開這種毀滅性疾病的複雜機制。香港中文大學(中大)生命科學學院陳浩然教授領導的研究團隊致力尋求突破,勢要揭開漸凍人症的致病機制助藥物研發,逆轉患者的死亡命運。最近,他們發現了患者體內有一個「搞事份子」:轉錄因子Yin Yang 1(YY1)— 一種控制基因信息轉錄至信使核糖核酸(messenger RNA)的蛋白,導致神經細胞死亡,令患者受著漸凍人症的折磨。有關的研究結果已在國際權威科學期刊《自然通訊》上發表。
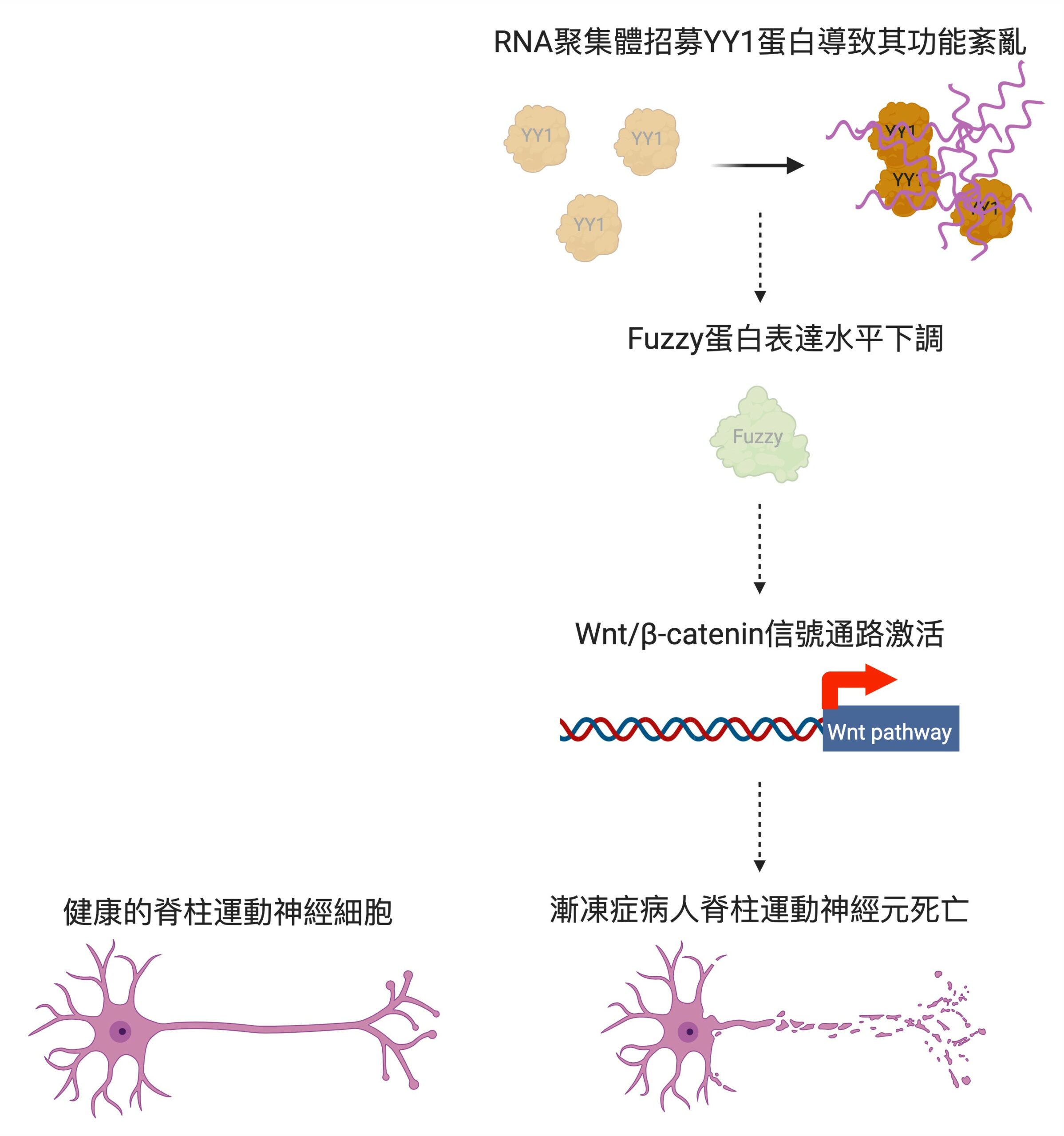
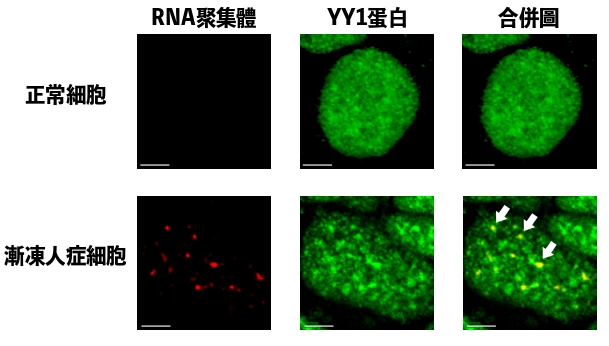
研究團隊發現,YY1負責轉錄一種名為Fuzzy的基因,當其功能紊亂就會降低了目標基因Fuzzy的表達,進而導致神經元細胞死亡,而漸凍人症患者因基因問題,其YY1在脊髓運動神經元RNA聚集體中聚集並出現功能紊亂。陳浩然教授說:「這過程干擾了RNA和YY1的關聯,YY1蛋白無法在神經元中發揮正常功能而導致神經退化。」因此,抑制這個致病信號通路有望逆轉漸凍人症患者脊髓運動神經元的細胞功能障礙。
這是中大與牛津大學臨床神經科學系Kevin Talbot教授之實驗室合作的一項研究。陳浩然教授的學生——博士後研究員陳哲凡博士在獲得利希慎臨床神經科學博士後研究項目資助後,到Kevin Talbot教授的實驗室進行研究,兩所大學遂於2018年展開合作。
為了實現這項目合作,陳哲凡博士從牛津大學回港後,在中大引入誘導性多能幹細胞(Induced pluripotent stem cell,iPSC)或其衍生的神經元重編程和分化技術,使中大能夠常規地進行神經元實驗。
基於致病機制的發現,陳浩然教授團隊篩選並合成目標分子,開發能夠抑制上述致病信號通路的藥物。研究團隊自2018年開始著手研究屬於BIND家族的肽類藥物。這類藥物已知可用於治療一系列嚴重及難治的遺傳性神經退化性疾病例如亨丁頓舞蹈症及小腦萎縮症。團隊在篩選了約100個不同版本的BIND後,最終開發了一種由21個氨基酸組成的肽分子,有望治療漸凍人症。此藥經研究團隊改良,令它能針對治療其中一種漸凍人症亞型「C9 ALS」。迄今已知漸凍人症約有34種不同基因問題引起的亞型,而「C9 ALS」亞型佔整體病例達40%。

陳浩然教授表示:「當我們用這藥物治療神經元時,發現它有效阻止RNA聚集體聚集YY1,神經元恢復了正常功能,包括能在彼此間重建突觸──即是連接的能力。」他續說,「突觸的形成可用於測量腦神經細胞之間信息傳遞的程度。在漸凍人症及其他神經退化性疾病中,當突觸的形成受到干擾,就會導致神經缺陷並引致身體活動能力出現問題。」
研究團隊至今已在細胞和果蠅模型測試此藥,效果良好,在取得實驗許可後將在囓齒動物和靈長類動物進行測試。團隊並正嘗試開發另一家族的肽藥物以進一步治療漸凍人症。此外,漸凍人症的致病機制眾多,研究團隊會嘗試發掘其他致病機制,如果成功,將有利開發更多具針對性的藥物,以救助全球眾多正受死亡威脅的漸凍人症患者。











